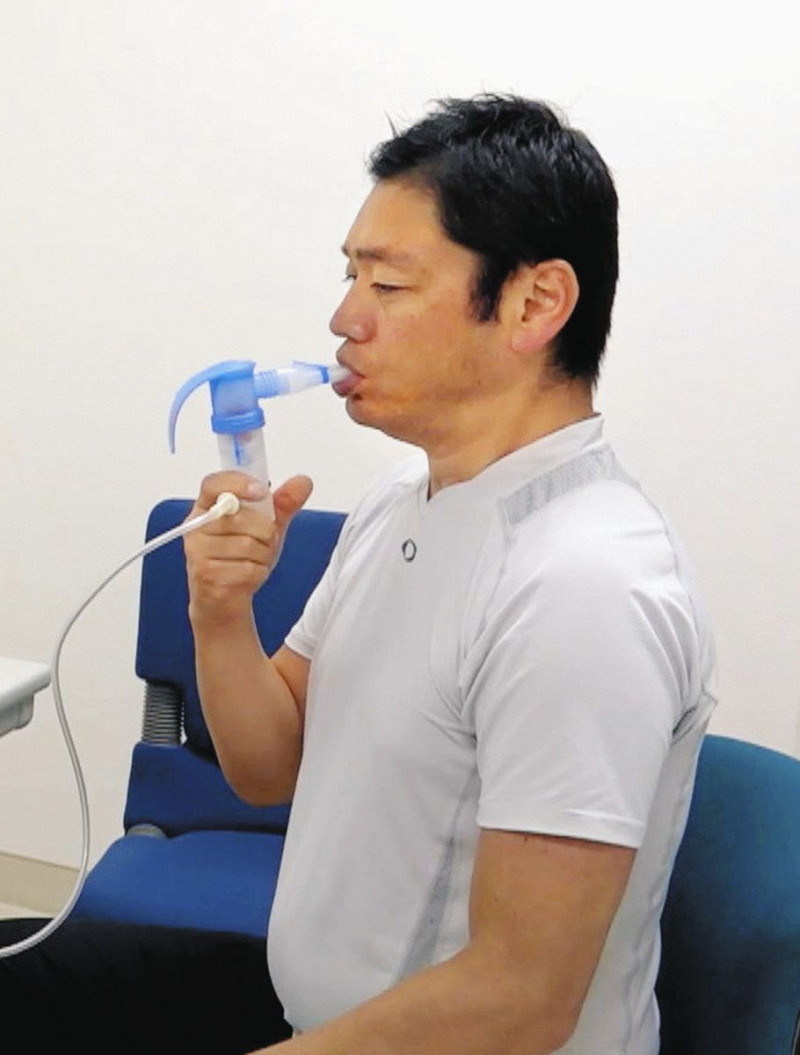
自己免疫性肺胞タンパク症の治療薬を吸入する患者=中田光さん提供
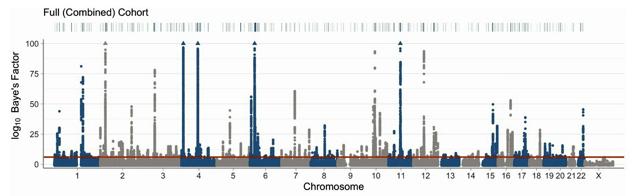
国指定の難病・自己免疫性肺胞タンパク症のメカニズムが日本人研究者によって解明され、世界初となる薬が7月に発売された。薬の開発に当たっては、希少疾患のため製薬会社を頼れず、医療者らが手弁当で治験を行って製品化にこぎつけた。希少疾患の新薬開発の在り方を考えるモデルケースになりそうだ。 (大森雅弥) 「肺胞タンパク症(PAP)」は、肺の中にある肺胞にタンパク質などの老廃物がたまって機能が落ちる病気。息切れや呼吸困難が起きる。患者の9割以上が自己免疫性。有病率は100万人当たり26人、発症後11年の死亡率は14%。発症直後は重症となり集中的な治療が必要なこともある。 従来の治療法は生理食塩水による肺洗浄。肺に水が入るので負担が大きく、数カ月から1年ごとに受ける必要がある。そんな治療を変えると期待されるのが、発売された吸入剤「サルグラモスチム(商品名・サルグマリン)」。厚生労働省が世界で初めて、有効性と安全性を確認して承認。保険適用も決まった。 開発は新潟大病院高度医療開発センター特任教授の中田光(こう)さん(70)=写真=の研究が基になった。 肺胞内の老廃物は「マクロファージ」と呼ばれる免疫細胞によって除去されるが、自己免疫性PAPの肺ではマクロファージが育たない現象が起きていた。中田さんはマクロファージを養う活性物質に着目。この物質を異物として排除してしまう抗体反応が起きていることを突き止めた。 活性物質を増やすことが必要で、中田さんらの研究グループは別の疾患の注射用薬品として発売されていた活性物質が新たにPAPに使えることを確認。霧状にして吸入するとよいことも明らかにした。 治療は隔週で24週、薬剤を吸入する。指定難病の医療費助成で患者の負担は月1万~2万円以下で済むという。中田さんは「多くの患者や担当医師が新薬のことを知らない。日本中に広めていきたい」と話す。 吸入療法の問い合わせは、「GM-CSF吸入推進機構」のホームページから。
開発は新潟大病院高度医療開発センター特任教授の中田光(こう)さん(70)=写真=の研究が基になった。 肺胞内の老廃物は「マクロファージ」と呼ばれる免疫細胞によって除去されるが、自己免疫性PAPの肺ではマクロファージが育たない現象が起きていた。中田さんはマクロファージを養う活性物質に着目。この物質を異物として排除してしまう抗体反応が起きていることを突き止めた。 活性物質を増やすことが必要で、中田さんらの研究グループは別の疾患の注射用薬品として発売されていた活性物質が新たにPAPに使えることを確認。霧状にして吸入するとよいことも明らかにした。 治療は隔週で24週、薬剤を吸入する。指定難病の医療費助成で患者の負担は月1万~2万円以下で済むという。中田さんは「多くの患者や担当医師が新薬のことを知らない。日本中に広めていきたい」と話す。 吸入療法の問い合わせは、「GM-CSF吸入推進機構」のホームページから。 ◆医療者150人が治験に協力
今回の新薬の承認に必要な治験は、製薬会社ではなく研究者自らが行った。「医師主導治験」と呼ばれる。 なぜ医師である研究者が製品化にまで関わらざるを得なかったのか。ひとえにPAPが希少疾患だからだ。中田さんら研究グループは当初、製薬会社に掛け合ったが、投資を回収できないと難色を示された。 そこで医薬品医療機器法(旧薬事法)の改正で2003年から導入された医師主導治験に取り組むことに。全国12病院、150人の医療者がボランティアで参加。製薬会社の治験のほぼ10分の1の資金で、承認に必要なデータをそろえることができた。中田さんは「患者さんが良くなること。それが私たちの最高の報酬」と言う。 一方、「今回は恵まれたケース」とも指摘。患者会の活動が活発で政治家の協力も得られた。その結果、難病の指定が得られ、実現に向けた動きが加速した。 4月現在、難病に指定されているのは341疾患。しかし、希少疾患は世界に7千もあるという。中田さんは「希少疾患については国が責任を持って薬の開発を支援する『国家薬』の制度を設けるべきだ」と指摘する。
鄭重声明:本文の著作権は原作者に帰属します。記事の転載は情報の伝達のみを目的としており、投資の助言を構成するものではありません。もし侵害行為があれば、すぐにご連絡ください。修正または削除いたします。ありがとうございます。